El espectro electromagnético (o simplemente espectro) es el rango de todas las radiaciones electromagnéricas posibles. El espectro de un objeto es la distribución característica de la radiación electromagnética de ese objeto.
El espectro electromagnético se extiende desde las bajas frecuencias usadas para la radio moderna (extremo de la onda larga) hasta los rayos gamma (extremo de la onda corta), que cubren longitudes de onda de entre miles de kilómetros y la fracción del tamaño de un átomo. Se piensa que el límite de la longitud de onda corta está en las cercanías de la longitud Planck, mientras que el límite de la longitud de onda larga es el tamaño del universo mismo, aunque en principio el espectro sea infinito y continuo.
Rango del espectro
El espectro cubre la energía de eondas electromagnéticas que tienen longitudes de onda diferentes. Las frecuencias de 30 Hz y más bajas pueden ser producidas por ciertas nebulosas estelares y son importantes para su estudio. Se han descubierto frecuencias tan altas como 2.9 * 1027 Hz a partir de fuentes astrofísicas.
La energía electromagnética en una longitud de onda particular λ (en el vacío) tiene una frecuencia asociada f y una energía fotónica E. Así, el espectro electromagnético puede expresarse en términos de cualquiera de estas tres variables, que están relacionadas mediante ecuaciones.
De este modo, las ondas electromagnéticas de alta frecuencia tienen una longitud de onda corta y energía alta; las ondas de frecuencia baja tienen una longitud de onda larga y energía baja.
Siempre que las ondas de luz (y otras ondas electromagnéticas) se encuentran en un medio (materia), su longitud de onda se reduce. Las longitudes de onda de la radiación electromagnética, sin importar el medio por el que viajen, son, por lo general, citadas en términos de longitud de onda en el vacío, aunque no siempre se declara explícitamente.
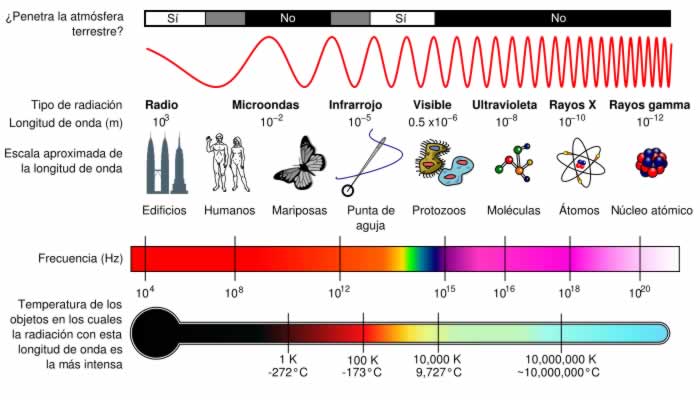
Generalmente, la radiación electromagnética se clasifica por la longitud de onda: ondas de radio, microondas, infrarroja y región visible, que percibimos como luz, rayos ultravioleta, rayos X y rayos gamma.
El comportamiento de la radiación electromagnética depende de su longitud de onda. Las frecuencias más altas tienen longitudes de onda más cortas, y las frecuencias inferiores tienen longitudes de onda más largas. Cuando la radiación electromagnética interacciona con átomos y moléculas, su comportamiento también depende de la cantidad de energía por cuanto que transporta. La radiación electromagnética puede dividirse en octavas (como las ondas sonoras).
La espectroscopia puede descubrir una región mucho más amplia del espectro que el rango visible de 400 nm a 700 nm. Un espectroscopio de laboratorio común puede descubrir longitudes de onda desde 2 nm a 2500 nm. Con este tipo de aparatos puede obtenerse información detallada sobre las propiedades físicas de objetos, gases o incluso estrellas. La espectrometría se usa sobre todo en astrofísica. Por ejemplo, muchos átomos de hidrógeno emiten ondas de radio que tienen una longitud de onda de 21.12 cm.
La energía electromagnética en una longitud de onda particular λ (en el vacío) tiene una frecuencia asociada f y una energía fotónica E. Así, el espectro electromagnético puede expresarse en términos de cualquiera de estas tres variables, que están relacionadas mediante ecuaciones.
De este modo, las ondas electromagnéticas de alta frecuencia tienen una longitud de onda corta y energía alta; las ondas de frecuencia baja tienen una longitud de onda larga y energía baja.
Siempre que las ondas de luz (y otras ondas electromagnéticas) se encuentran en un medio (materia), su longitud de onda se reduce. Las longitudes de onda de la radiación electromagnética, sin importar el medio por el que viajen, son, por lo general, citadas en términos de longitud de onda en el vacío, aunque no siempre se declara explícitamente.
Generalmente, la radiación electromagnética se clasifica por la longitud de onda: ondas de radio, microondas, infrarroja y región visible, que percibimos como luz, rayos ultravioleta, rayos X y rayos gamma.
El comportamiento de la radiación electromagnética depende de su longitud de onda. Las frecuencias más altas tienen longitudes de onda más cortas, y las frecuencias inferiores tienen longitudes de onda más largas. Cuando la radiación electromagnética interacciona con átomos y moléculas, su comportamiento también depende de la cantidad de energía por cuanto que transporta. La radiación electromagnética puede dividirse en octavas (como las ondas sonoras).
La espectroscopia puede descubrir una región mucho más amplia del espectro que el rango visible de 400 nm a 700 nm. Un espectroscopio de laboratorio común puede descubrir longitudes de onda desde 2 nm a 2500 nm. Con este tipo de aparatos puede obtenerse información detallada sobre las propiedades físicas de objetos, gases o incluso estrellas. La espectrometría se usa sobre todo en astrofísica. Por ejemplo, muchos átomos de hidrógeno emiten ondas de radio que tienen una longitud de onda de 21.12 cm.
Tipos de radiación
Aunque el esquema de clasificación suele ser preciso, en realidad existe algo de trasposición entre tipos vecinos de energía electromagnética. Por ejemplo, las ondas de radio a 60 Hz pueden ser recibidas y estudiadas por astrónomos, o pueden ser conducidas a lo largo de cables como energía eléctrica. También, algunos rayos gamma de baja energía realmente tienen una longitud de onda más larga que algunos rayos X de gran energía. Esto es posible porque "rayo gamma" es el nombre que se le da a los fotones generados en la descomposición nuclear u otros procesos nucleares y subnucleares, mientras que los rayos X son generados por transiciones electrónicas que implican electrones interiores muy energéticos. Por lo tanto, la diferencia entre rayo gamma y rayo X está relacionada con la fuente de radiación más que con la longitud de onda de la radiación. Generalmente, las transiciones nucleares son mucho más energéticas que las transiciones electrónicas, así que los rayos gamma suelen ser más energéticos que los rayos X. Sin embargo, hay transiciones nucleares de baja energía (p.ej. la transición nuclear de 14.4 keV del Fe-57) que producen rayos gamma que son menos energéticos que algunos de los rayos X de mayor energía.
Radiofrecuencia
Las ondas de radio suelen ser utilizadas mediante antenas del tamaño apropiado (según el principio de resonancia), con longitudes de onda en los límites de cientos de metros a aproximadamente un milímetro. Se usan para la transmisión de datos, a través de la modulación. La televisión, los teléfonos móviles, las resonancias magnéticas, o las redes inalámbricas y de radio-aficionados, son algunos usos populares de las ondas de radio.
Las ondas de radio pueden transportar información variando la combinación de amplitud, frecuencia y fase de la onda dentro de una banda de frecuencia. El uso del espectro de radio está regulado por muchos gobiernos mediante la asignación de frecuencias. Cuando la radiación electromagnética impacta sobre un conductor, se empareja con él y viaja a lo largo del mismo, induciendo una corriente eléctrica en la superficie de ese conductor mediante la excitación de los electrones del material de conducción. Este efecto (el efecto piel) se usado en las antenas. La radiación electromagnética también puede hacer que ciertas moléculas absorban energía y se calienten, una característica que se utiliza en en los microondas.
Microondas
La frecuencia super alta (SHF) y la frecuencia extremadamente alta (EHF) de las microondas son las siguientes en la escala de frecuencia. Las microondas son ondas los suficientemente cortas como para emplear guías de ondas metálicas tubulares de diámetro razonable. La energía de microondas se produce con tubos klistrón y tubos magnetrón, y con diodos de estado sólido como los dispositivos Gunn e IMPATT. Las microondas son absorbidas por la moléculas que tienen un momento dipolar en líquidos. En un horno microondas, este efecto se usa para calentar la comida. La radiación de microondas de baja intensidad se utiliza en Wi-Fi.
El horno microondas promedio, cuando está activo, está en un rango cercano y bastante poderoso como para causar interferencia con campos electromagnéticos mal protegidos, como los que se encuentran en dispositivos médicos móviles y aparatos electrónicos baratos.
Rayos T
La radiación de terahertzios (o Rayos T) es una región del espectro situada entre el infrarrojo lejano y las microondas. Hasta hace poco, este rango estaba muy poco estudiado, ya que apenas había fuentes para la energía microondas en el extremo alto de la banda (ondas submilimétrica o también llamadas ondas terahertzios). Sin embargo, están apareciendo aplicaciones para mostrar imágenes y comunicaciones. Los científicos también buscan aplicar la tecnología de rayos T en las fuerzas armadas, donde podrían usarse para dirigirlas a las tropas enemigas, ya que las ondas de alta frecuencia incapacitan los equipos electrónicos.
Radiación infrarroja
La parte infrarroja del espectro electromagnético cubre el rango desde aproximadamente los 300 GHz (1 mm) hasta los 400 THz (750 nm). Puede ser dividida en tres partes:
* Infrarrojo lejano, desde 300 GHz (1 mm) hasta 30 THz (10 μm). La parte inferior de este rango también puede llamarse microondas. Esta radiación es absorbida por los llamados modos rotatorios en las moléculas en fase gaseosa, mediante movimientos moleculares en los líquidos, y mediante fotones en los sólidos. El agua en la atmósfera de la Tierra absorbe tan fuertemente esta radiación que confiere a la atmósfera efectividad opaca. Sin embargo, hay ciertos rangos de longitudes de onda ("ventanas") dentro del rango opaca¡o que permiten la transmisión parcial, y pueden ser usados en astronomía. El rango de longitud de onda de aproximadamente 200 μm hasta unos pocos mm suele llamarse "radiación submilimétrica" en astronomía, reservando el infrarrojo lejano para longitudes de onda por debajo de los 200 μm.
* Infrarrojo medio, desde 30 a 120 THz (10 a 2.5 μm). Los objetos calientes (radiadores de cuerpo negro) pueden irradiar fuertemente en este rango. Se absorbe por vibraciones moleculares, es decir, cuando los diferentes átomos en una molécula vibran alrededor de sus posiciones de equilibrio. Este rango es llamado, a veces, región de huella digital, ya que el espectro de absorción del infrarrojo medio de cada compuesto es muy específico.
* Infrarrojo cercano, desde 120 a 400 THz (2500 a 750 nm). Los procesos físicos que son relevantes para este rango son similares a los de la luz visible.
Radiación visible (luz)
La frecuencia por encima del infrarrojo es la de la luz visible. Este es el rango en el que el Sol y las estrellas similares a él emiten la mayor parte de su radiación. No es probablemente una coincidencia que el ojo humano sea sensible a las longitudes de onda que el sol emite con más fuerza. La luz visible (y la luz cercana al infrarrojo) son absorbidas y emitidas por electrones en las moléculas y átomos que se mueven desde un nivel de energía a otro. La luz que vemos con nuestros ojos es realmente una parte muy pequeña del espectro electromagnético. Un arco iris muestra la parte óptica (visible) del espectro electromagnético; el infrarrojo (si pudiera verse) estaría localizado justo a continuación del lado rojo del arco iris, mientras que el ultravioleta estaría tras el violeta.
La radiación electromagnética con una longitud de onda entre aproximadamente 400 nm y 700 nm es detectado por el ojo humano y percibida como luz visible. A otras longitudes de onda, sobre todo al infrarrojo cercano (más largo de 700 nm) y al ultravioleta (más corto que 400 nm) también se les llama luz a veces, sobre todo cuando la visibilidad para los humanos no es relevante.
Si la radiación que tiene una frecuencia en la región visible del espectro electromagnético se refleja en un objeto, como por ejemplo un plato hondo de fruta, y luego impacta en nuestros ojos, obtenemos una percepción visual de la escena. El sistema visual de nuestro cerebro procesa la multitud de frecuencias reflejadas en diferentes sombras y matices, y a través de este fenéomeno psicofísico que todavía no se entiende completamente, es como percibiríamos los objetos.
En la mayor parte de las longitudes de onda, sin embargo, la información transportada por la radiación electromagnética no es directamente descubierta por los sentidos humanos. Las fuentes naturales producen radiación electromagnética a través del espectro, y nuestra tecnología también puede manipular un amplio rango de longitudes de onda. La fibra óptica transmite luz que, aunque no es adecuada para la visión directa, puede transportar datos que luego son traducidos en sonido o imagen. La codificación usada en tales datos es similar a lo que se usa con las ondas de radio.
Luz ultravioleta
La siguiente frecuencia en el espectro es el ultravioleta (o rayos UV), que es la radiación cuya longitud de onda es más corta que el extremo violeta del espectro visible.
Al ser muy energética, la radiación ultravioleta puede romper enlaces químicos, haciendo a las moléculas excepcionalmente reactivas o ionizándolas, lo que cambia su comportamiento. Las quemaduras solares, por ejemplo, están causadas por los efectos perjudiciales de la radiación UV en las células de la piel, y pueden causar incluso cáncer de piel si la radiación daña las moléculas de ADN complejas en las células (la radiación UV es un mutágeno). El Sol emite una gran cantidad de radiación UV, lo que podría convertir rápidamente la Tierra en un desierto estéril si no fuera porque, en su mayor parte, es absorbida por la capa de ozono de la atmósfera antes de alcanzar la superficie.
Rayos X
Después del ultravioleta vienen los rayos X. Los rayos X duros tienen longitudes de onda más cortas que los rayos X suaves. Se usan generalmente para ver a través de algunos objetos, así como para la física de alta energía y la astronomía. Las estrellas de neutrones y los discos de acreción alrededor de los agujeros negros emiten rayos X, lo que nos permite estudiarlos.
Los rayos X pasan por la mayor parte de sustancias, y esto los hace útiles en medicina e industria. También son emitidos por las estrellas, y especialmente por algunos tipos de nebulosas. Un aparato de radiografía funciona disparando un haz de electrones sobre un "objetivo". Si los electrones se disparan con suficiente energía, se producen rayos X.
Rayos gamma
Después de los rayos X duros vienen los rayos gamma. Son los fotones más energéticos, y no se conoce el límite más bajo de su longitud de onda. Son útiles a los astrónomos en el estudio de objetos o regiones de alta energía, y son útiles para los físicos gracias a su capacidad penetrante y su producción de radioisótopos. La longitud de onda de los rayos gamma puede medirse con gran exactitud por medio de dispersión Compton.
No hay ningún límite exactamente definido entre las bandas del espectro electromagnético. Algunos tipos de radiación tienen una mezcla de las propiedades de radiaciones que se encuentran en las dos regiones del espectro. Por ejemplo, la luz roja se parece a la radiación infrarroja en que puede resonar algunos enlaces químicos.
Radiofrecuencia
Las ondas de radio suelen ser utilizadas mediante antenas del tamaño apropiado (según el principio de resonancia), con longitudes de onda en los límites de cientos de metros a aproximadamente un milímetro. Se usan para la transmisión de datos, a través de la modulación. La televisión, los teléfonos móviles, las resonancias magnéticas, o las redes inalámbricas y de radio-aficionados, son algunos usos populares de las ondas de radio.
Las ondas de radio pueden transportar información variando la combinación de amplitud, frecuencia y fase de la onda dentro de una banda de frecuencia. El uso del espectro de radio está regulado por muchos gobiernos mediante la asignación de frecuencias. Cuando la radiación electromagnética impacta sobre un conductor, se empareja con él y viaja a lo largo del mismo, induciendo una corriente eléctrica en la superficie de ese conductor mediante la excitación de los electrones del material de conducción. Este efecto (el efecto piel) se usado en las antenas. La radiación electromagnética también puede hacer que ciertas moléculas absorban energía y se calienten, una característica que se utiliza en en los microondas.
Microondas
La frecuencia super alta (SHF) y la frecuencia extremadamente alta (EHF) de las microondas son las siguientes en la escala de frecuencia. Las microondas son ondas los suficientemente cortas como para emplear guías de ondas metálicas tubulares de diámetro razonable. La energía de microondas se produce con tubos klistrón y tubos magnetrón, y con diodos de estado sólido como los dispositivos Gunn e IMPATT. Las microondas son absorbidas por la moléculas que tienen un momento dipolar en líquidos. En un horno microondas, este efecto se usa para calentar la comida. La radiación de microondas de baja intensidad se utiliza en Wi-Fi.
El horno microondas promedio, cuando está activo, está en un rango cercano y bastante poderoso como para causar interferencia con campos electromagnéticos mal protegidos, como los que se encuentran en dispositivos médicos móviles y aparatos electrónicos baratos.
Rayos T
La radiación de terahertzios (o Rayos T) es una región del espectro situada entre el infrarrojo lejano y las microondas. Hasta hace poco, este rango estaba muy poco estudiado, ya que apenas había fuentes para la energía microondas en el extremo alto de la banda (ondas submilimétrica o también llamadas ondas terahertzios). Sin embargo, están apareciendo aplicaciones para mostrar imágenes y comunicaciones. Los científicos también buscan aplicar la tecnología de rayos T en las fuerzas armadas, donde podrían usarse para dirigirlas a las tropas enemigas, ya que las ondas de alta frecuencia incapacitan los equipos electrónicos.
Radiación infrarroja
La parte infrarroja del espectro electromagnético cubre el rango desde aproximadamente los 300 GHz (1 mm) hasta los 400 THz (750 nm). Puede ser dividida en tres partes:
* Infrarrojo lejano, desde 300 GHz (1 mm) hasta 30 THz (10 μm). La parte inferior de este rango también puede llamarse microondas. Esta radiación es absorbida por los llamados modos rotatorios en las moléculas en fase gaseosa, mediante movimientos moleculares en los líquidos, y mediante fotones en los sólidos. El agua en la atmósfera de la Tierra absorbe tan fuertemente esta radiación que confiere a la atmósfera efectividad opaca. Sin embargo, hay ciertos rangos de longitudes de onda ("ventanas") dentro del rango opaca¡o que permiten la transmisión parcial, y pueden ser usados en astronomía. El rango de longitud de onda de aproximadamente 200 μm hasta unos pocos mm suele llamarse "radiación submilimétrica" en astronomía, reservando el infrarrojo lejano para longitudes de onda por debajo de los 200 μm.
* Infrarrojo medio, desde 30 a 120 THz (10 a 2.5 μm). Los objetos calientes (radiadores de cuerpo negro) pueden irradiar fuertemente en este rango. Se absorbe por vibraciones moleculares, es decir, cuando los diferentes átomos en una molécula vibran alrededor de sus posiciones de equilibrio. Este rango es llamado, a veces, región de huella digital, ya que el espectro de absorción del infrarrojo medio de cada compuesto es muy específico.
* Infrarrojo cercano, desde 120 a 400 THz (2500 a 750 nm). Los procesos físicos que son relevantes para este rango son similares a los de la luz visible.
Radiación visible (luz)
La frecuencia por encima del infrarrojo es la de la luz visible. Este es el rango en el que el Sol y las estrellas similares a él emiten la mayor parte de su radiación. No es probablemente una coincidencia que el ojo humano sea sensible a las longitudes de onda que el sol emite con más fuerza. La luz visible (y la luz cercana al infrarrojo) son absorbidas y emitidas por electrones en las moléculas y átomos que se mueven desde un nivel de energía a otro. La luz que vemos con nuestros ojos es realmente una parte muy pequeña del espectro electromagnético. Un arco iris muestra la parte óptica (visible) del espectro electromagnético; el infrarrojo (si pudiera verse) estaría localizado justo a continuación del lado rojo del arco iris, mientras que el ultravioleta estaría tras el violeta.
La radiación electromagnética con una longitud de onda entre aproximadamente 400 nm y 700 nm es detectado por el ojo humano y percibida como luz visible. A otras longitudes de onda, sobre todo al infrarrojo cercano (más largo de 700 nm) y al ultravioleta (más corto que 400 nm) también se les llama luz a veces, sobre todo cuando la visibilidad para los humanos no es relevante.
Si la radiación que tiene una frecuencia en la región visible del espectro electromagnético se refleja en un objeto, como por ejemplo un plato hondo de fruta, y luego impacta en nuestros ojos, obtenemos una percepción visual de la escena. El sistema visual de nuestro cerebro procesa la multitud de frecuencias reflejadas en diferentes sombras y matices, y a través de este fenéomeno psicofísico que todavía no se entiende completamente, es como percibiríamos los objetos.
En la mayor parte de las longitudes de onda, sin embargo, la información transportada por la radiación electromagnética no es directamente descubierta por los sentidos humanos. Las fuentes naturales producen radiación electromagnética a través del espectro, y nuestra tecnología también puede manipular un amplio rango de longitudes de onda. La fibra óptica transmite luz que, aunque no es adecuada para la visión directa, puede transportar datos que luego son traducidos en sonido o imagen. La codificación usada en tales datos es similar a lo que se usa con las ondas de radio.
Luz ultravioleta
La siguiente frecuencia en el espectro es el ultravioleta (o rayos UV), que es la radiación cuya longitud de onda es más corta que el extremo violeta del espectro visible.
Al ser muy energética, la radiación ultravioleta puede romper enlaces químicos, haciendo a las moléculas excepcionalmente reactivas o ionizándolas, lo que cambia su comportamiento. Las quemaduras solares, por ejemplo, están causadas por los efectos perjudiciales de la radiación UV en las células de la piel, y pueden causar incluso cáncer de piel si la radiación daña las moléculas de ADN complejas en las células (la radiación UV es un mutágeno). El Sol emite una gran cantidad de radiación UV, lo que podría convertir rápidamente la Tierra en un desierto estéril si no fuera porque, en su mayor parte, es absorbida por la capa de ozono de la atmósfera antes de alcanzar la superficie.
Rayos X
Después del ultravioleta vienen los rayos X. Los rayos X duros tienen longitudes de onda más cortas que los rayos X suaves. Se usan generalmente para ver a través de algunos objetos, así como para la física de alta energía y la astronomía. Las estrellas de neutrones y los discos de acreción alrededor de los agujeros negros emiten rayos X, lo que nos permite estudiarlos.
Los rayos X pasan por la mayor parte de sustancias, y esto los hace útiles en medicina e industria. También son emitidos por las estrellas, y especialmente por algunos tipos de nebulosas. Un aparato de radiografía funciona disparando un haz de electrones sobre un "objetivo". Si los electrones se disparan con suficiente energía, se producen rayos X.
Rayos gamma
Después de los rayos X duros vienen los rayos gamma. Son los fotones más energéticos, y no se conoce el límite más bajo de su longitud de onda. Son útiles a los astrónomos en el estudio de objetos o regiones de alta energía, y son útiles para los físicos gracias a su capacidad penetrante y su producción de radioisótopos. La longitud de onda de los rayos gamma puede medirse con gran exactitud por medio de dispersión Compton.
No hay ningún límite exactamente definido entre las bandas del espectro electromagnético. Algunos tipos de radiación tienen una mezcla de las propiedades de radiaciones que se encuentran en las dos regiones del espectro. Por ejemplo, la luz roja se parece a la radiación infrarroja en que puede resonar algunos enlaces químicos.
Fuente :
POR:
De la Torre Vazquez Jesus Alejandro
Becerra Hernandez Jose Gpe.





.jpg)